Propiedades de las sustancias gracias a los enlaces químicos
Introducción al enlace químico: ¿Por qué se enlazan los átomos?
Para comprender algunas propiedades de las
sustancias y explicar el comportamiento que tienen las mismas en el mundo
macro, es importante que podamos adquirir conocimientos de la dependencia de
este comportamiento con los enlaces químicos que hacen que los átomos
individuales, se conglomeren en moléculas.
En la naturaleza los gases nobles, son como
gases monoatómicos, el resto de elementos químicos se hallan en la naturaleza
enlazados a otros átomos, es decir, formando moléculas. Podemos tener moléculas sencillas, como los gases diatómicos: oxígeno: O2,
nitrógeno: N2, hidrógeno: H2, cloro: Cl2,
entre otras o moléculas complejas, como el benceno, la glucosa o las macromoléculas biológicas
(lípidos, proteínas, glúcidos, ácidos nucleicos).

¿Por qué sucede
esto? ¿Por qué se unen o enlazan los átomos entre sí?
Se trata esencialmente de una cuestión
energética. La energía del agregado atómico es menor que la suma de energías de
los átomos por separado. Los procesos naturales tienden a la mínima energía, ya
que los sistemas con menor energía son más estables. Por tanto, los átomos
unidos son más estables que por separado, y esta es la razón de que los átomos
se unan entre sí; forman lo que llamamos el enlace químico.
En la formación
de un enlace químico siempre se produce un cambio en la configuración electrónica respecto a la de los átomos
aislados. Esto también puede expresarse como que, al enlazarse, los átomos
adquieren una configuración electrónica más
estable, motivo por el cual los gases nobles no se enlazan: la configuración electrónica de un átomo de gas noble
es de por sí muy estable.
Esta modificación en la configuración electrónica como consecuencia de la
formación de un enlace químico dio
lugar al establecimiento de una teoría electrónica de valencia para el enlace químico. Las bases de esta teoría fueron establecidas
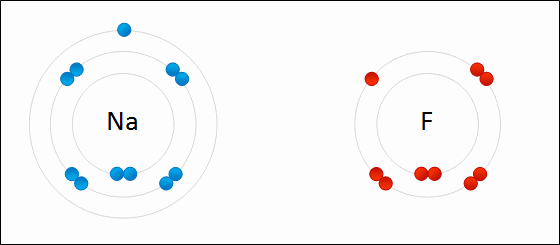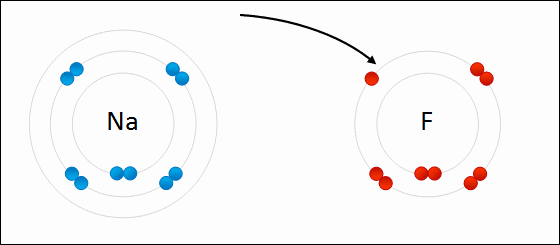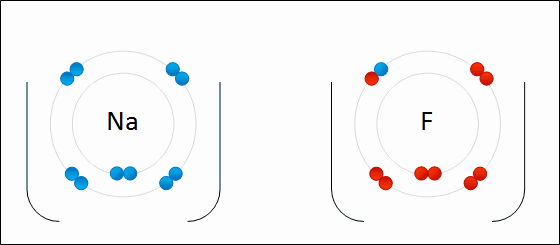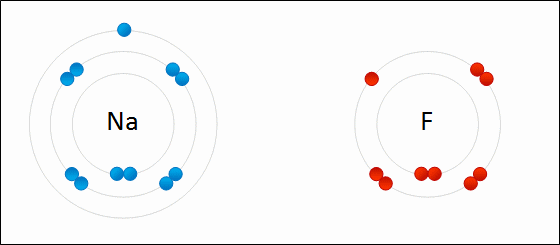
en 1916 por Kossel y Lewis de forma independiente. Kossel, para el enlace iónico; Lewis, para el enlace covalente.
Ambos autores consideran que los átomos tienen
una capa electrónica externa que puede contener hasta 8 electrones (2 en un
orbital s y 6 en los orbitales p), que se conoce como Regla del octeto, y es una configuración
electrónica especialmente estable, pues representa la configuración electrónica de un gas noble. Por ello, ambos autores sugirieron que los
átomos se enlazan intentando alcanzar estos 8 electrones en la última capa, por
cesión, captación o compartición. Aunque esta regla es útil en muchos casos,
existen numerosas excepciones. Esencialmente, existen 3 tipos de enlaces químicos que son llamadas las fuerzas intramoleculares.
Fuerzas intramoleculares
Son las fuerzas que hacen posible la
unión de átomos, para que se dé la formación de moléculas (ya sea de elementos
moleculares como H2, O2, N2, Cl2,
o compuestos como H2O, CO2, C6H12O6,
entre otros). Dependiendo de la unión de los átomos y su necesidad de cumplir
con la regla del octeto, estas fuerzas se dan en diferentes tipos de enlaces,
entre los que encontramos el enlace metálico, el enlace
iónico,
el enlace covalente,
que a su vez pueden ser polares o apolares. Gracias a los enlaces es que se
determinan las propiedades químicas de las sustancias o compuestos.

Enlace iónico
Enlace covalente

Adaptado de http://www.quimitube.com/videos/introduccion-al-enlace-quimico-por-que-se-enlazan-los-atomos

Comentários
Postar um comentário